- Equipe IPCR (localisation : Calais)
Microscope confocal Leica STELLARIS 5
 Le principe de la microscopie confocale à balayage laser est de réaliser des sections optiques permettant une imagerie tridimensionnelle de tissus biologiques. Le Stellaris 5 permet d’adapter la bande spectrale d’émission à tous types de sondes fluorescentes. Il offre une possibilité de balayage spectral pour caractériser un fluorophore ou pour séparer deux sondes dont les spectres se chevauchent. Il est équipé de quatre lasers pour couvrir l’ensemble des fluorophores visibles et proche IR. Ses trois détecteurs permettent une acquisition simultanée de trois canaux de fluorescence, le quatrième détecteur est dédié à l’imagerie à champ clair (DIC).
Le principe de la microscopie confocale à balayage laser est de réaliser des sections optiques permettant une imagerie tridimensionnelle de tissus biologiques. Le Stellaris 5 permet d’adapter la bande spectrale d’émission à tous types de sondes fluorescentes. Il offre une possibilité de balayage spectral pour caractériser un fluorophore ou pour séparer deux sondes dont les spectres se chevauchent. Il est équipé de quatre lasers pour couvrir l’ensemble des fluorophores visibles et proche IR. Ses trois détecteurs permettent une acquisition simultanée de trois canaux de fluorescence, le quatrième détecteur est dédié à l’imagerie à champ clair (DIC).
Utilisations courantes :
- Imagerie 3D
- Colocalisation
- Quantifications de signal
- Microscope également destiné aux F-techniques (FRAP, FRET)
Modes d’acquisition :
- Microscopie confocale multicanaux
- Reconstruction 3D, scan XZ
- Imagerie spectrale, séparation spectrale
- Timelaps (gestion de l’autofocus intégrée)
- Multiposition, mosaïques
- Imagerie à champ clair DIC (contraste interférentiel différentiel)
- Cubes filtres de fluorescences : DAPI, GFP et Rhodamine
Microscope :
Statif inversé Leica DMi8
Platine motorisée XY Surplatine galvanométrique super Z pour des échantillons fixés entre lame et lamelle ou des échantillons vivants sur lame, boîte de Petri ou plaque multipuits.
Objectifs :
- 4x HC PL FLUOTAR 4x/0.13
- 10x HC PL APO 10x/0.40 CS2 (distance de travail 2.56mm)
- 20x HC PL APO 20x/0.75 CS2 (distance de travail 0.62mm)
- 16x HC FLUOTAR L 16x/0.6 IMM (distance de travail 2.5mm)
- 63x HC PLA APO 63x/1.40 Oil CS2 (distance de travail 0.14mm)
Lasers :
- Laser 405nm (50mW)
- Laser 488nm (20mW)
- Laser 561nm (20mW)
- Laser 638nm (30mW)
Détecteurs :
- 3 détecteurs HyD S spectraux
- 1 Détecteur pour lumière transmise
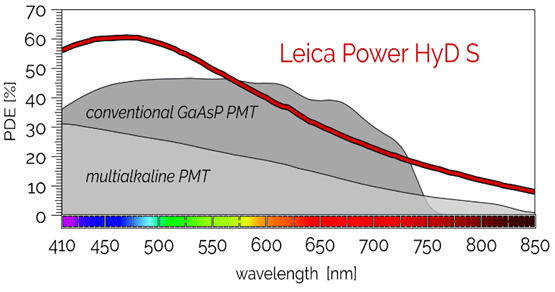 La conception des HyD permet une sensibilité et un rapport signal/bruit accrus par rapport à un PMT classique et une imagerie de comptage de photon peu bruitée.
La conception des HyD permet une sensibilité et un rapport signal/bruit accrus par rapport à un PMT classique et une imagerie de comptage de photon peu bruitée.
Scanners :
Scanner conventionnel (10im/s) et scanner Résonant (28im/s)
Logiciel :
Logiciel de contrôle incluant un module de déconvolution adaptative (technologie LIGHTNING) et un module d’acquisition de mosaïque.
Applications :
Grâce au développement d’une grande variété de protéines et de sondes fluorescentes, il est possible de marquer et visualiser pratiquement n’importe quelle molécule ou structure dans les tissus/cellules animales ou végétales. Il est possible de suivre des processus biologiques complexes tels que la mitose, les modifications du cytosquelette, l’accumulation de molécules au niveau cellulaire, … et aussi de pouvoir répondre aux questionnements de dynamique et d’interactions moléculaires sur des matériels biologiques vivants.
Ce matériel est associé à un microtome à rotation semi-automatique (LEICA HistoCore MULTICUT R) permettant de produire des coupes en paraffine reproductibles et uniformes et à un microtome à lame vibrante ( Leica VT1200) conçu pour les coupes d’échantillons fixés ou non fixés.
Illustrations :

Trois microscopes optiques trinoculaires
 OLYMPUS BX40 (10X 20X 40X 100X) direct
OLYMPUS BX40 (10X 20X 40X 100X) direct- OLYMPUS CKX 41 (10X-40X) inversé
- NIKON Eclipse E600 à fluorescence (FITC / DAPI) et contraste de phase (10X 20X 40X 50X 100X)
Système d’aquisition d’images & de vidéo couleur haute résolution adaptée à la fluorescence
- Caméra Olympus DP74
- Capteur CMOS couleur à bruit faible n fluorescence
- Résolution max : 5760 x 3600 pixels
- Vidéo 60 i/sec
- Logiciel CellSens Olympus
WinRHIZOTM
Système d’analyse d’image (scanner & logiciel) dans sa version « Regular » pour l’étude de la morphologie des systèmes racinaires des plantes.
Caractéristiques (version « REG »), mesures morphologiques automatisées :
Mesures globales (sur image)
- Nombre
- Longueur totale
- Diamètre moyen
- Aire totale
- Nombres de racines principales et secondaires
Mesures affinées
- Détermination des proportions (%) de racines épaisses vs fines (selon le diamètre)
- Pour chaque classe définie :
- Nombre
- Longueur
- Surface
- Volume
- Pour chaque classe définie :
Possibilité de comptage manuel de nodules ETC.
Localisation : Bâtiment UCEIV Calais
Système portatif permettant de mesurer sur une feuille l’activité photosynthétique, la transpiration, la conductance stomatique, le CO2 interne et la vapeur de pression différentielle
Caractéristiques :
- Analyseur de gaz CO2 et H2O Infrarouge de haute précision
- 1 module de fluorescence de la Chlorophylle et de lumière LED pour des mesures simultanées de la Photosynthèse et Fluorescence de la Chlorophylle
- 1 Capteur de rayonnement PAR (Photosynthetically Active Radiation)
- 1 capteur de température infrarouge dans la cuvette sous la feuille permettant de mesurer, sans contact, la température foliaire
- 1 capteur de température dans la cuvette pour mesurer et réguler la température
- 1 capteur de pression pour mesurer la pression atmosphérique
- 1 Pince universelle avec 3 fenêtres interchangeables (18mm de diamètre/2,5cm2) adaptée à différentes tailles de feuilles
- 1 Chambre permettant la mesure de la respiration du sol
Applications :
Évaluation de l’état de santé d’une plante soumise à un stress biotique ou abiotique par la mesure des échanges gazeux foliaires et de l’activité photosynthétique. Un module optionnel permet également de mesurer la respiration du sol.
Localisation : Bâtiment UCEIV Calais
- 1 Salle de culture

Culture en conditions semi contrôlée
- Température régulée homogène
- Éclairement lumineux fixe, alternance jour/nuit
- 12 Chambres climatiques MLR-352-H

Culture en conditions contrôlées par microprocesseur PiD
- Températures programmables de 0°C à 50°C sur 12 étapes
- Eclairement lumineux programmable de 0 à 20000 lux
- Réglage de l’humidité relative de 55% à 90%
Localisation : Bâtiment UCEIV Calais
- Real-Time PCR Detection Systems : BIO-RAD
 Caractéristiques :
Caractéristiques :
Logiciel d’analyse d’expression des gènes : CFX ManagerTM qui permet l’analyse rapide de l’expression relative de gènes différentiellement exprimée. Assistant de création de protocoles et aide au choix de gènes de ménages adaptés aux matrices travaillées. L’appareil contient un bloc de 96 puits.
- Thermocyleur : SureCycler 8800 Agilent®
 Caractéristiques :
Caractéristiques :
L’appareil contient un bloc de 96 puits, avec des volumes de réactions compris entre 10-100µL. Capacité de mémoire de 10000 protocoles, montée en température de 6°C/sec. Gamme de gradient intra bloc de 30 à 99°C, permettant l’optimisation de couples d’amorces dessinées au laboratoire.
Applications :
L’ensemble de ces appareils permet de suivre l’expression de gènes d’intérêt liés à l’état de santé d’une plante soumise à un stress biotique ou abiotique en conditions contrôlées (température, lumière, humidité).
Notre équipe a développé une expertise quant aux réponses du blé tendre (Triticum aestivum L.) en réaction à :
- Une inoculation par des champignons pathogènes (Zymoseptoria tritici ou Blumeria graminissp. tritici),
- Une inoculation par des organismes bénéfiques (champignons mycorhiziens)
- Une pulvérisation par des éliciteurs de sources diverses (algues, bactéries, champignon, extraits de plantes supérieures, acides organiques etc.).
Localisation : Bâtiment UCEIV Calais
Système modulaire Micro-ondes Multiwave 3000 Anton Paar
L’extraction assistée par micro-ondes présente de nombreux avantages par rapport aux techniques conventionnelles, tels que la réduction du temps d’extraction, l’augmentation des rendements d’extraction et la diminution de l’utilisation de solvants.
Ce système permet la mesure et le contrôle précis, sans fil, des températures et pressions internes des réacteurs.
Grâce à ces 16 réacteurs indépendants, il limite les Trans contaminations et permet d’atteindre une grande reproductibilité des process
Quelques exemples d’applications pour la préparation assistée par microondes des échantillons :
-Digestion acide pour l’extraction des Eléments Traces dans les matrices végétales ou sols
-Extraction solide/liquide (solvant) de molécules organiques telles que les polluants (dioxines/furanes, alcanes et HAP) dans les matrices végétales ou les sols
-Evaporation / concentration (acide / aqueux) accélérée des échantillons
Localisation : Bâtiment UCEIV Calais
- Spectrophotomètre AGILENT CARY 100
 Caractéristiques :
Caractéristiques :
- Spectrophotomètre double faisceau UV – Visible (Tungstène – Halogène) avec une plage de travail au-delà de 4,0 Abs.
- Enregistrement des spectres d’absorption et/ou de transmission sur la gamme spectrale 190 nm – 900 nm (bande passante 0,20-4,00 nm).
- Bloc Support Multicell 6×6 cuvettes à effet Peltier et contrôleur de température (-10°C – 100 °C)
- Lecteur de microplaques multimode SpectraMax® iD3
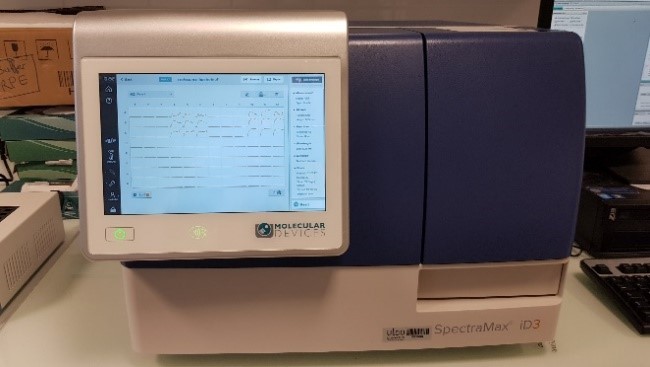 Caractéristiques :
Caractéristiques :
- Mesure l’Absorbance, la FLuorescence et la Luminescence
- 6 à 384 puits – agitation linéaire orbitale double
- Contrôle des températures : +5°C à +66°C
- Abs : 230 à 1000 nm – FL excitation : 250 à 830 nm – FL émission : 270 à 850 nm – Lumi : 300 à 850 nm
Quelques exemples d’applications :
- Mesures des croissances bactériennes et fongiques
- Mesures des activités enzymatiques : peroxydase, catalase, Glutathion S-transférase etc.
- Mesures des activités anti-inflammatoires et anti-oxydantes des huiles essentielles
- Quantification de l‘ADN extrait des sols ou du matériel végétal ou fongique
- Détection et quantification des protéines
- Quantification des composés extraits des végétaux : composés phénoliques totaux, chlorophylles totales et carotènes…
Localisation : Bâtiment UCEIV Calais

